OBJETIVO: Construir baterías electroquimica en casa con materiales de deshechos.
Podemos usar materiales de deshecho para construir rápidamente una batería electroquimica en casa y demostrar que las reacciones químicas producen una corriente eléctrica.
Audiencia
Todo aquel que desee generar electricidad a partir de la basura =)Donativos
Si está información te ha sido útil piensa en donar algo, por pequeño que sea, lo corresponderé aumentando la información aquí expuesta además de poder continuar con los experimentos. Gracias de antemano.
BTC: 1P6hs8WUFaTUHitye74XfYiWwdf57EJbVA
QRK: QNL7KtDizUcC4M9G9CsQxzV4kAD3eBwCGA
Historia
En el anio 600 a.C. Tales de Mileto, descubrió al frotar una vara de ámbar, con una tela de seda, una fuerza misteriosa que podía atraer pajillas. =)
En 1600 William Gilbert llama es este tipo de fenómenos como eléctricos, debido a que la palabra griega
ámbar traduce elektrón al latín.
En 1660 Otto Von Guericke creo una maquina que producía chispas por fricción.
En 1746 Pieter van Musschenbroek, demostró que se podía almacenar la electricidad en el agua, colocando una varilla de metal en una botella llena de agua al que luego le acercaría un conductor cargado de electricidad estática, si una persona tocaba la varilla recibía una descarga.
En 1747 Willian Watson perfecciono la botella, hoy en día se conoce como la Botella de Leyden y fue el primer
condensador. (Se le denominaba condensador por la creencia que la electricidad era una especia de fluido que podía ser almacenado.)
En 1752 Benjamin Franklin trabajo en un condensador para almacenar electricidad estática.
De pronto!!
En 1780 Luigi Galvani, estaba diseccionando una rana, sujeta con un gancho de metal. Cuando tocó la pata de la rana con su bisturí de hierro, la pierna se encogió como si el animal aún estuviese vivo. Galvani creía que la energía que había impulsado la contracción muscular observada venía de la misma pierna, y la llamó "electricidad animal"


Y por fin!!
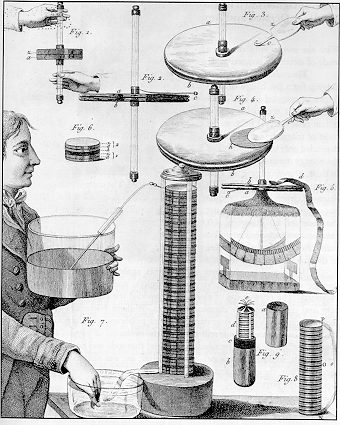 La idea surgio a partir de la observación de su amigo
Luigi Galvani, Volta se dio cuenta que los dos metales disimiles en un medio humedo (la rana) generaba electricidad, si! , Galvani realmente estaba electrificando a la rana =D y esta contraía sus músculos que de hecho si funcionaban con impulsos eléctricos.
La idea surgio a partir de la observación de su amigo
Luigi Galvani, Volta se dio cuenta que los dos metales disimiles en un medio humedo (la rana) generaba electricidad, si! , Galvani realmente estaba electrificando a la rana =D y esta contraía sus músculos que de hecho si funcionaban con impulsos eléctricos.
Volta coloco dos metales diferentes, cobre y zinc, en un recipiente de agua salada, al conectar ambos metales con un alambre conductor genero electricidad.
Aumento el voltaje apilando muchos de estos recipientes conectándolos en serie formando la primera batería eléctrica en la historia.
Aumento el voltaje apilando muchos de estos recipientes conectándolos en serie formando la primera batería eléctrica en la historia.
 Pero realmente fue la primera? En 1936 arqueólogos encontraron en Bagdad vasijas que tenían en su interior un rollos de lamina de cobre que contenía una varilla de hierro, la fecha estimada de antigüedad es del 248 a.C.
Pero realmente fue la primera? En 1936 arqueólogos encontraron en Bagdad vasijas que tenían en su interior un rollos de lamina de cobre que contenía una varilla de hierro, la fecha estimada de antigüedad es del 248 a.C.Lo único que necesitaban para producir electricidad era agua, pero hasta la fecha la llamada Batería de Bagdad es un misterio.
Experimento 1: Reproducir La Bateria de Bagdad
Ahora que sabemos un poco de la historia de la Pila a Coronas de Volta-Galvani y la enigmática Batería de Bagdad tendremos una idea de como elaborar nuestra propia pila casera con metales diferentes en un medio húmedo.
Algunos arqueólogos piensan que se usaba el vinagre de las uvas de Bagdad como el medio electrolítico en aquellas vasijas del 200 a.C. por lo que intentaremos reproducir una de estas baterías de Bagdad.
Algunos arqueólogos piensan que se usaba el vinagre de las uvas de Bagdad como el medio electrolítico en aquellas vasijas del 200 a.C. por lo que intentaremos reproducir una de estas baterías de Bagdad.
Solo se necesita una vara de hierro envuelto en papel, este se insertara dentro de una tubería de cobre (o se enrollara en alambres de cobre) y esta se colocara dentro de una botella con vinagre.
Medimos con un multimetro colocando los terminales respectivamente en la varilla de hierro y en el tubo de cobre.
Si colocamos un alambre conductor externo entre el hierro y el cobre al cabo de unos días notaremos que el hierro esta corroído, originalmente Volta pensaba que esto era un defecto que podría corregir con el tiempo, en aquel momento nunca se imagino que es precisamente la reacción química de oxidación, genera la corriente eléctrica.
Experimento 2: Batería con lata de refresco
Lista de materiales:
Buscaremos en la basura los siguientes materiales
- latas de refresco (Aluminio)
- esponja metalica (Acero)
- papel
- agua
- sal
Procedimiento:
Con un abrelatas quita la tapa superior de la lata de refresco.
Envuelve en papel la esponja metálica y colócala dentro de la lata.
Vierte agua.
Medimos con un multimetro colocando los terminales respectivamente en la lata de aluminio y en la esponja de acero.
Ahora colocamos un poquito de sal al gusto en el agua, volvemos a medir =)
La corrosión genera una corriente eléctrica, para esto es necesario cuatro elementos:
Al faltar alguno de estos cuatro elementos la corrosión no ocurrirá ni se generara la corriente eléctrica.
Que electrodo sera ánodo o cátodo dependerá de la combinación del par de elementos.
El mecanismo electroquimico ocurre en dos semi-reacciones: oxidacion y reduccion
la reaccion de oxidacion se puede expresar como:
M → M+ + e-
Donde M es el elemento en su estado inmune, al reaccionar con el agua (electrolito) pierde electrones y se forman iones M+
Pero si M pierde electrones otro elemento lo debe ganar, digamo C, por asignar una letra que en cierta forma recuerda al catodo y al carbon.
C+ + e- → C
La tendencia a reducir u oxidar a otros elementos químicos se cuantifica por el potencial electrico de reduccion.
Ahora, podemos buscar una tabla de potenciales estandares Eº con respecto al hidrógeno H, esta nos dará una idea de como combinar pares de elementos para obtener mas voltaje.
Envuelve en papel la esponja metálica y colócala dentro de la lata.
Vierte agua.
Medimos con un multimetro colocando los terminales respectivamente en la lata de aluminio y en la esponja de acero.
Ahora colocamos un poquito de sal al gusto en el agua, volvemos a medir =)
Experimento 3: Una pila, apilando celdas de aluminio y monedas
Esto quiza es lo mas semejante a la pila a corona de Volta, al igual de los otros experimentos tenemos que evitar el contacto directo entre los metales que estan en el agua, usaremos papel humedo para separar circulos de aluminio de las monedas. Luego las apilaremos en serie.Experimento 4: Pila de tierra =)
Hacemos lo mismo que el anterior solo que usaremos tierra humeda en lugar de papel.Teoría
La corrosión genera una corriente eléctrica, para esto es necesario cuatro elementos:
- ánodo: es el elemento que se oxidara, liberando electrones.
- cátodo: es el elemento que recibe electrones y esta protegido de la oxidación.
- electrolíto: sustancia que transporta los iones, generalmente liquidos.
- retorno: un conductor que conecta externamente a los electrodos ánodo y cátodo, conduciendo una corriente de retorno.
Al faltar alguno de estos cuatro elementos la corrosión no ocurrirá ni se generara la corriente eléctrica.
Que electrodo sera ánodo o cátodo dependerá de la combinación del par de elementos.
Reaccion de oxido-reduccion (o redox)
El mecanismo electroquimico ocurre en dos semi-reacciones: oxidacion y reduccion
la reaccion de oxidacion se puede expresar como:
M → M+ + e-
Donde M es el elemento en su estado inmune, al reaccionar con el agua (electrolito) pierde electrones y se forman iones M+
Pero si M pierde electrones otro elemento lo debe ganar, digamo C, por asignar una letra que en cierta forma recuerda al catodo y al carbon.
C+ + e- → C
La tendencia a reducir u oxidar a otros elementos químicos se cuantifica por el potencial electrico de reduccion.
| Nº | Reaccion de reduccion | Eº (V) | Elemento |
| 1 | Li+ + e- → Li | −3.02 | Litio |
| 2 | Cs+ + e- → Cs | −3.02 | |
| 3 | Rb+ + e- → Rb | −2.99 | |
| 4 | K+ + e- → K | −2.92 | |
| 5 | Ba2+ + 2e- → Ba | −2.90 | |
| 6 | Sr2+ + e- → Sr | −2.89 | |
| 7 | Ca2+ + 2e- → Ca | −2.87 | |
| 8 | Na+ + e- → Na | −2.71 | |
| 9 | Mg2+ + 2e- → Mg | −2.34 | |
| 10 | Al3+ + 3e- → Al | −1.57 | Aluminio |
| 11 | Mn2+ + 2e- → Mn | −1.05 | |
| 12 | Zn2+ + 2e- → Zn | −0.76 | |
| 13 | Fe2+ + 2e- → Fe | −0.44 | Hierro |
| 14 | Cd2+ + 2e- → Cd | −0.40 | |
| 15 | Co2+ + 2e- → Co | −0.28 | |
| 16 | Ni2+ + 2e- → Ni | −0.25 | Niquel |
| 17 | Sn2+ + 2e- → Sn | −0.14 | |
| 18 | Pb2+ + 2e- → Pb | −0.18 | |
| 19 | 2H+ + 2e- → H2 | 0 | Hidrogeno |
| 20 | S + 2e- → S2- | 0.14 | |
| 21 | Cu2+ + e- → Cu- | 0.15 | Cobre |
| 22 | Cu2+ + 2e- → Cu | 0.34 | Cobre |
| 23 | ClO- + H2O + 2e- → Cl- + 2OH- | 0.52 | |
| 24 | I2 + 2e- → 2I- | 0.53 | |
| 25 | MnO4- + 2H2O +3e- → MnO2 + 4OH- | 0.57 | |
| 26 | Fe3+ + e-^ → Fe’^2+ | 0.77 | Hierro |
| 27 | Ag+ + e- → Ag | 0.8 | |
| 28 | NO3- + 2H+ + e- → NO2 + H2O | 0.81 | |
| 29 | NO3- + 4H+ + 3e- → NO + 2H2O | 0.96 | |
| 30 | ClO- + H2O + 2e- → ClO3- + H2O | 1 | |
| 31 | Br2 + 2e- → Br- | 1.07 | |
| 32 | MnO2 + 4H+ + 2e- → Mn2+ + 2H2O | 1.21 | |
| 33 | Cr2O72- + 14H+ + 6e0^-^’ → 2Cr3+ + 7H2O | 1.36 | |
| 34 | Cl2 + 2e- → 2Cl- | 1.36 | |
| 35 | Au3+ + 3e- → Au | 1.42 | |
| 36 | MnO4- + 8H+ + 5e- → Mn2+ + 4H2O | 1.52 | |
| 37 | H2O2 + 2H+ + 2e- → 2H2O | 1.77 | |
| 38 | F2 + 2e- → 2F- | 2.86 | Fluor |
Esta claro que la combinación de Litio y Fluor Li-F es la tentadora, pero se podrá usar? tendremos que saber primero si estos pueden estar juntos sin reaccionar violentamente, el Litio en estado puro es muy inestable, el fluor es muy reactivo, quien sabe que pasaria ....???
El Litio tiene un potencia de -3,02 y el Fluor de 2.86 por lo que el Litio sera el anodo que se oxidara, formando una corriente electrica de 2,86 - (-3,02) = 5,88 Voltios
Pero de donde saco el Fluor y el Litio? Por cierto que se que el Litio no puede estar en el agua, hacer que el agua arda, dado que nuestros cuerpos tienen mucha agua es mejor alejarse
El Litio tiene un potencia de -3,02 y el Fluor de 2.86 por lo que el Litio sera el anodo que se oxidara, formando una corriente electrica de 2,86 - (-3,02) = 5,88 Voltios
Pero de donde saco el Fluor y el Litio? Por cierto que se que el Litio no puede estar en el agua, hacer que el agua arda, dado que nuestros cuerpos tienen mucha agua es mejor alejarse
Tiene una vida útil de 5000 recargas
10% de perdida mensual de carga.
se carga en 1 hora.
La combinación Niquel-Hierro Ni-Fe fue concibida en 1903 por Thomas Edison
- cátodo: 2 NiOOH + 2 H2O + 2 e– ↔ 2 Ni(OH)2 + 2 OH–
- ánodo: Fe + 2 OH– ↔ Fe(OH)2 + 2 e–
Con una duración esperada de 100 anios, se cambia el cátodo cada 20 anios =D
Referencias
http://html.rincondelvago.com/celdas-electroquimicas_baterias_pilas.html
http://html.rincondelvago.com/electricidad_1.html
http://www.monografias.com/trabajos89/la-electroquimica/la-electroquimica.shtml
http://es.wikipedia.org/wiki/Bater%C3%ADa_(electricidad)#Bater.C3.ADas_de_n.C3.ADquel-hierro_.28Ni-Fe.29
http://html.rincondelvago.com/electricidad_1.html
http://www.monografias.com/trabajos89/la-electroquimica/la-electroquimica.shtml
http://es.wikipedia.org/wiki/Bater%C3%ADa_(electricidad)#Bater.C3.ADas_de_n.C3.ADquel-hierro_.28Ni-Fe.29

oyes tengo una duda y de donde cojones saco el litio , teniedo el fluor a la majo jejejj espero me ayudes gracias
ResponderEliminarJajaja y de donde se saca el flour? tengo entendido que el litio se encuentra mezclado con otros elementos en algunas rocas, pero que en estado puro es sumamente inestable, reacciona violentamente con el agua, tanto que hace que el agua arda, se debe a que por un lado se produce hidrogeno y calienta tanto el agua que esta arde.
ResponderEliminarhttp://www.youtube.com/watch?feature=player_embedded&v=oxhW7TtXIAM
Si tienes las manos sudadas te vas a quemar XD, por cierto, que se puede sacar de las pilas de litio pero hay que saber abrir el protector de acero que la cubre y saber manipular el litio.
Las baterías Li-Po no son de Litio-Polonio (yo también lo creí en su momento), sino de un polímero de litio. No pueden ser de Polonio, básicamente, porque es un material radiactivo y sería muy peligroso manejarlas
ResponderEliminar